INTRODUKSI IMUNOBIOLOGI
MAWAR PUTRI JULICA
07/ 250270/ KG/ 08134
Laboratorium Biologi Mulut, Fakultas Kedokteran Gigi, Universitas Gadjah Mada, Yogyakarta
Reaksi antigen-antibodi dapat di deteksi dengan reaksi sekunder untuk memvisualisasikan reaksi misalkan presipitasi maupun aglutinasi. Klasifikasi antigen salah satunya bersumber dari alogeneik dengan jenis alloantigen salah satu contohnya adalah golongan darah. Dua jenis penggolongan darah yang paling penting adalah penggolongan ABO dan Rhesus (faktor Rh). Membran sel darah merah pada sebagian besar individu mengandung suatu substansi golongan darah tipe A, tipe B, tipe AB, tipe O. Penggolongan sistem ABO didasarkan pada ada atau tidaknya aglutinasi antara antigen-antibodi yang terdapat dalam darah, sedangkan penggolongan Rh berdasarkan ada atau tidaknya antigen D. Jika seseorang dengan Rh negatif (tidak mempunyai antigen D) terpajan dengan darah Rh positif (mempunyai antigen D), maka tubuh akan membentuk anti-Rh sehingga menyebabkan aglutinasi.
Untuk melihat adanya aglutinasi, tes yang dilakukan adalah mereaksikan darah sebagai antigen dan larutan anti sera( Anti-A, Anti-B, Anti-C, dan Anti-D). Aglutinasi dapat menunjukkan golongan darah. Sedangkan pada penghitungan jenis leukosit sample darah dibuat sediaan tipis lalu dicat dengan Giemsa 3%. Kemudian sediaan diamati dibawah mikroskop, dilakukan perhitungan macam jenis leukosit per 100 sel leukosit sepanjang sediaan apus. Hasil penghitungan dilaporkan dalam bentuk persen.
Kedua percobaan tersebut dilakukan pada tiga orang probandus dengan hasil :
- Probandus I : golongan darah O, Rh positif, basofil 0%, eosinofil 0%, netrofil 0%, limfosit 75%, monosit 18%
- Probandus II: golongan darah O, Rh positif, basofil 2,4%, eosinofil 14,8%, netrofil 54,3%, limfosit 8,6%, monosit 7,4 %
- Probandus III: golongan darah O, Rh positif, basofil 10,1%, eosinofil 10,1%, netrofil 43,4%, limfosit 30,4%, monosit 5,7 %
Penghitungan Diffferential Blood Count (DBC) ternyata secara klinis juga sangat membantu dalam diagnosis suatu kondisi patologis. Kenaikan titer salah satu atau beberapa jenis leukosit memberi makna kondisi tertentu yang dapat fisiologis maupun patologis.
Kata kunci : aglutinasi, hitung diferensial leukosit, antigen, antibodi
PENDAHULUAN
Dalam pengertian paling luas , immunologi mengacu pada semua mekanisme pertahanan yang dapat di mobilisasi oleh tubuh untuk memerangi ancaman invasi asing. Respon imun itu hampir seluruhnya diperantarai oleh limfosit B dan limfosit T. Saat terjadi respon imun terhadap benda asing, limfosit B terutama terlibat dalam menghasilkan protein-protein globular yang disebut Antibodi.(Fried, G.H and Fried, G.J., 2006). Imunigenisitas dapat di definisikan sebagai sesuatu zat (immunogen) yang memberikan zat tersebut kemampuan membangkitkan respon imun spesifik baik antibody maupun imunitas seluler. Bagian dari struktur tiga dimensi tiap imunogen mengandung kelompok permukaan misalnya asam amino dalam suatu protein globularatau sisi rantai sakarida yang menonjol pada polisakarida. Struktur ini diberi nama determinan antigenic atau epitop dan menyajikan daerah aktif terpapar, dengan mana antibody menyatu .(Bellanti & Jackson, 1993)
Jika terdapat suatu agen asing yang dapat dikenali oleh system imunitas, maka hal ini dapat memicu produksi molekul protein khusus yang secara umum disebut antibodi. Antibodi sendiri merupakan senjata utama respon humoral. Reseptor sel T yang akan mengenali agensia asing tersebut secara spesifik dan mengikatnya. Molekul yang dapat dikenali dan diikat oleh reseptor sel T yang disebut antigen (antibody generating surface).(Yuwono,2008)
Interaksi antigen-antibodi dapat dibagi dalam 3 kategori: (1)primer, (2) sekunder,(3) tersier. Interaksi primer atau interaksi awal antigen dengan antibody adalah suatu kejadian dasar yang terdiri dari pengikatan molekul antigen dengan antibody. deteksi biasanya dikerjakan dengan reaksi sekunder, yang merupakan alat bantu untuk memvisualisasikan reaksi, misalnya presipitasi. Reaksi tersier merupakan ekspresi biologik dari interaksi antigen-antibodi yang dapat berguna untuk merusak. Pada Aglutinasi, fase pertama penyatuan antigen-antibodi terjadi seperti pada presipitasi dan tergantung pada kekuatan ion, pH dan suhu. Pada aglutinasi sel darah merah, misalnya dimana reseptor antigenik mungkin terletak pada cekungan yang dalam pada permukaan sel, antibody diikat kuat pada sisi reseptor pada satu sel. (Bellanti, 1993)
Ketika transfusi darah dari orang ke orang, transfusi hanya berhasil baik pada beberapa keadaan. Seringkali timbul aglutinasi dan hemolisis sel darah merah bahkan dapat juga menyebabkan kematian. Ternyata hal itu dikarenakan darah dari orang yang berbeda biasanya mempunyai sifat antigen dan imunitas yang berbeda, sehingga antibodi dalam plasma darah seseorang akan bereaksi dengan antigen pada permukaan sel darah merah orang lain. Karl Landsteiner menggolongkan darah manusia menjadi A, B, AB, dan O. Metode klasifikasi berdasarkan jenis antigen dan antibodi yang terkandung dalam darahnya. Jenis penggolongan darah lain adalah dengan memanfaatkan faktor Rhesus atau faktor Rh.
Tubuh kita ini mempunyai sistem pertahanan tubuh yang bekerja melalui dua cara. Pertama adalah merusak benda asing yang menyerbu (antigen) dengan cara fagositosis. Kedua, menon-aktifkan benda asing tadi dengan membentuk antibodi spesifik. Proses yang kedua ini telah dicontohkan pada kasus golongan darah yang telah dijelaskan sebelumnya. Sedang untuk proses fagositosis sendiri dilakukan oleh leukosit Ada enam macam sel darah putih yang secara normal ditemukan dalam darah. Netrofil polimorfonuclear, eosinofil polimorfonuclear, basofil polimorfonuclear, merupakan sel-sel yang polimorfonuclear (berinti >1) dan mempunyai gambaran granular, maka disebut sel granulosit. Fungsi utama limfosit dan sel plasma adalah berhubungan dengan sistem imun seseorang. Sel-sel darah putih manusia normalnya berkisar antara 4.000 – 11.000 sel per mikroliter darah . Rentang normal elemen seluler pada darah manusia dapat dilihat pada tabel di bawah ini:
|
Sel/ mL (rata-rata)
|
Rentang normal
|
Presentase WBC
|
| Total WBC |
9.000
|
4000 – 11.000
|
…
|
| Granulocytes
Neutrophils |
5.400
|
3.000 – 6.000
|
50 – 70
|
| Eosinophils |
275
|
150 – 300
|
1 – 4
|
| Basophils |
35
|
0 – 100
|
0,4
|
| Lymphocytes |
2.750
|
1.500 – 4.000
|
20 – 40
|
| Monocytes |
540
|
300 – 600
|
2 – 8
|
| Erythrocytes |
4,8 – 5,4 X 106
|
…
|
…
|
| Platelets |
300.000
|
200.000 – 500.000
|
…
|
Di antara sel dalam tabel di atas, granulosit (leukosit PMN) yang paling banyak. Granulosit muda mempunyai inti berbentuk seperti tapal kuda yang menjadi multilobulus waktu sel tumbuh menjadi semakin tua. Sebagian besar granulosit mengandung granula yang berwarna dengan zat warna asam (eosinofil) dan sebagian mempunyai granula basofilik (basofil). Dua jenis sel lainnya yang normal ditemukan dalam darah tepi adalah limfosit, yaitu sel dengan inti besar dan bulat dan sedikit sitoplasma, dan monosit, yaitu sel dengan banyak sitoplasma agranuler dan inti berbentuk ginjal.(Ganong, 2001)
Tujuan dari praktikum ini adalah agar mahasiswa mampu melakukan tes aglutinasi terhadap pemeriksaan golongan darah dan menjelaskan hasilnya, memahami dan mempelajari prosedur pembuatan sediaan sampel darah dengan metode oles (smear methods), serta mengenal beberapa istilah dalam bidang imunobiologi.
BAHAN DAN CARA
v Pemeriksaan Golongan Darah ABO dan Rh
A. Alat dan Bahan
1. Gelas obyek
2. Satu set larutan anti sera
a. Serum anti-A, warna biru
b. Serum anti-B, warna kuning
c. Serum anti-AB, tidak berwarna
d. Serum anti-D berisi IgG dan IgM, tidak berwarna
B. Cara Kerja
1.Menyiapkan gelas obyek dan menandainya dengan empat buah tanda yaitu daerah A, B, AB,dan D.
2.Pada tiap tanda diteteskan darah dari probandus masing-masing satu tetes. Berturut-turut serum anti-A, anti-B, anti-AB, dan anti-D diteteskan pada setiap tetes darah yang ada di atas gelas obyek sesuai dengan tanda yang tertera.
3.Tiap campuran tetes darah dan tetes serum diaduk dengan ujung gelas obyek yang lain.
Identifikasi dan Kuantitatif Sel Leukosit
- Alat dan Bahan
1.Darah
2.Gelas obyek
3.Aquades
4.Methyl-alkohol
5. Cat Giemsa 3%
6. Mikroskop cahaya
7.Hand tally counter
8.Minyak imersi
9.Lancet
10.Kapas Alkohol
- Cara Kerja
v Pembuatan Sediaan Film Darah Tipis
1. Menyiapkan dua buah gelas obyek, A dan B.
2. Meneteskan darah pada sisi kanan gelas obyek A.
3. Menarik gelas obyek B sedikit ke belakang sehingga tetesan darah dari gelas obyek A tersentuh dan terjadi gaya kapilaritas, sehingga darah tersebar sepanjang sisi gelas obyek B. Antara gelas obyek A dan B dibentuk sudut kira-kira 25o-45o.
4. Mendorong gelas obyek B ke sisi kiri gelas obyek A dengan mantap dan cepat sehingga terjadi film darah yang tipis. Melakukan pengecatan satu jam setelah pembuatan.
v Pengecatan
1. Melakukan fiksasi dengan mencelupkan sediaan dalam wadah yang berisi methyl-alkohol selama 3-4 menit kemudian mengeringkannya dalam suhu ruang.
2. Menetesi seluruh permukaan sediaan oles dengan cat Giemsa 3% selama 30-40 menit.
3. Kemudian mencuci sediaan yang telah dicat tersebut dengan aquades dingin dan mengeringkannya pada suhu ruang.
v Cara Pemeriksaan
Sediaan diamati mulai dari daerah kepala hingga ekor dengan mikroskop pada perbesaran obyektif 10 kali. Bagian yang diamati adalah bagian yang eritrositnya tidak saling menumpuk. Setelah itu meneteskan minyak imersi dan mengamati dengan perbesaran mikroskop 100 kali. Menghitung masing-masing jenis leukosit per 100 sel leukosit, hasil dilaporkan dalam persen.
HASIL PENGAMATAN
Pemeriksaan Golongan Darah ABO dan Rh, serta Identifikasi dan Kuantitatif Sel Leukosit masing-masing dilakukan terhadap tiga orang probandus. Dari ketiga percobaan tersebut didapatkan hasil sebagai berikut:
Tabel hasil pemeriksaan golongan darah ABO dan Rh
|
Aglutinasi Terjadi Pada |
Penilaian Golongan Darah |
Aglutinasi Terjadi Pada |
Penilaian |
|
Anti-A
|
Anti-B
|
Anti-AB
|
Anti-D
|
Rh
|
| Probandus 1 |
–
|
–
|
–
|
O
|
+
|
Positif
|
| Probandus 2 |
–
|
–
|
–
|
O
|
+
|
Positif
|
| Probandus 3 |
–
|
–
|
–
|
O
|
+
|
Positif
|
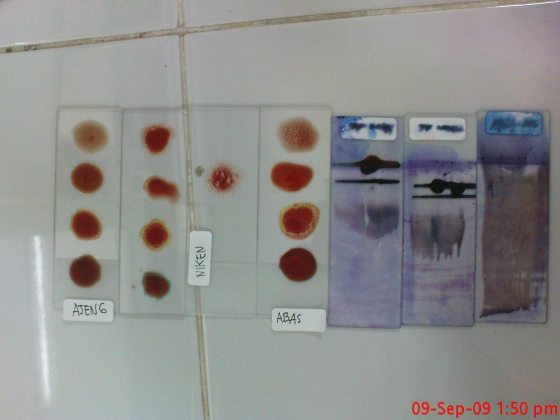
hasil praktikum pengetesan golongan darah
Probandus 1 Probandus 2 Probandus 3
v Identifikasi leukosit
| Macam Sel |
Probandus 1 |
Probandus 2 |
Probandus 3 |
| Basofil |
0% |
24% |
10,1% |
| Eosinofil |
0% |
14,8% |
10,1% |
| Netrofil |
6% |
54,3% |
43,4% |
| Limfosit |
75% |
8,6% |
30,4% |
| Monosit |
18% |
7,4% |
5,7 % |
Keterangan:
*Perhitungan probandus 1 menggunakan perbesaran 1000x
*Probandus 2 dan 3 menggunakan perbesaran 400X
PEMBAHASAN
Kelompok antigen yang memiliki banyak arti klinis adalah kelompok antigen yang dikenal sebagai antigen alogeneik, yaitu antigen yang secara genetic diatur oleh determinan antigenic yang membedakan satu individu spesies tertentu dari individu lain pada spesies yang sama. Pada manusia determinan antigenic semacam ini terdapat pada sel darah merah, contoh alloantigen: ABO, RHo, golongan darah(disebut isoantigen), memiliki fungsi klinik untuk penyakit hemofilik pada neonatus dan reaksi transfusi.(Bellanti & Jackson, 1993)
Penggolongan darah sistem ABO yang kita kenal ditentukan berdasarkan ada atau tidaknya aglutinogen A dan B.Aglutinogen merupakan antigen, disebut juga aglutinogen karena dia mampu menyebabkan reaksi aglutinasi sel darah. Bila tidak terdapat aglutinogen tipe A dalam sel darah merah seseorang, maka dalam plasmanya akan terbentuk antibodi yang dikenal sebagai aglutinin anti-A. Demikian pula, bila tidak terdapat aglutinogen tipe-B di dalam sel darah merah, maka dalam plasmanya terbentuk antibodi yang dikenal sebagai aglutinin anti-B. Golongan darah O, meskipun tidak mengandung aglutinogen, tetapi mengandung agglutinin anti-A dan anti-B. Golongan darah A mengandung aglutinogen tipe-A dan aglutinin anti-B, sedangkan golongan darah B mengandung aglutinogen tipe-B dan aglutinin anti-A. Golongan darah AB mengandung kedua aglutinogen A dan B, tetapi tidak mengandung aglutinin sama sekali.
|
Golongan Darah
|
Aglutinogen
|
Aglutinin
|
|
O
|
–
|
Anti-A dan Anti-B
|
|
A
|
A
|
Anti-B
|
|
B
|
B
|
Anti-A
|
|
AB
|
A dan B
|
–
|
Tabel golongan darah beserta aglutinogen dan aglutininnya
Pemeriksaan Golongan Darah ABO dan Rh pada percobaan kali ini menggunakan sampel darah yang dicampur aglutinin anti-A dan aglutinin anti-B, kemudian diamati sel darah merah yang “teraglutinasi” untuk mengetahui adanya reaksi antibodi-antigen. Dari ketiga probandus, semuanya bergolongan darah O karena saat ditetesi serum anti-A dan anti-B tidak terjadi reaksi aglutinasi. Jika individu memiliki aglutinin Anti-A dan Anti-B ditetesi dengan serum yang sama, maka tidak terjadi ikatan antigen-antibodi yang secara makroskopis dapat diamati dengan reaksi aglutinasi. (Guyton & Hall, 2007)
Bila darah yang tidak cocok dicampur sehingga aglutinin plasma anti-A atau anti-B dicampur dengan sel darah merah yang mengandung aglutinogen A atau B, terjadilah aglutinasi sel darah merah. Terdapat dua tahapan aglutinasi, yang pertama adalah perlekatan molekul antibodi dengan antigen yang tidak terlarut, kedua terjadi pembentukan pola-pola geometris (Sheehan, 1997). Menurut Guyton & Hall (2007), proses aglutinasi diawali oleh aglutinin bivalen atau polivalen yang akan melekatkan diri pada sel darah merah. Karena aglutinin mempunyai dua tempat pengikatan (tipe IgG) atau 10 tempat pengikatan (IgM), maka satu aglutinin dapat melekatkan diri pada dua atau lebih sel darah merah yang berbeda pada waktu yang sama, dengan demikian menyebabkan sel saling mendekat satu sama lain. Keadaan ini menyebabkan sel-sel menggumpal bersama-sama (aglutinasi). Kemudian gumpalan ini menyumbat pembuluh darah kecil di seluruh sistem sirkulasi, dan pada akhirnya terjadi hemolisis sel darah merah.
Seperti yang kita ketahui, karena orang bergolongan darah O tidak mempunyai antigen A dan B, maka dia bisa mendonorkan darahnya kepada resipien lain yang tidak sama golongan darahnya. Itulah sebabnya golongan darah O disebut donor universal. Namun donor darah terkadang juga memberikan efek tertentu, salah satunya adalah menekan fungsi imunitas seseorang sehingga dapat meningkatkan kerentanan seseorang terhadap infeksi, tetapi hal ini tidak terjadi secara tetap. Pada tahun 1997, Eaves-Pyles & Alexander mengemukakan bahwa kemampuan dari tranfusi darah untuk meningkatkan kemampuan bakteri untuk menginfeksi bergantung pada faktor genetik seseorang.
Pada hasil uji rhesus, didapatkan hasil bahwa ketiga probandus memiliki rhesus positif ,namun pada probandus ke 2 dibutuhkan dua kali pengetesan untuk anti D baru didapatkan hasil positif, hal ini dimungkinkan karena kesalahan praktikan pada saat pemberian jumlah tetesan anti D pada pengetesan pertama. Seseorang yang mempunyai rhesus positif berarti dia memiliki antigen D, sedangkan seseorang yang tidak memiliki antigen D dikatakan sebagai rhesus negatif. Penyakit yang sering berhubungan dengan rhesus adalah penyakit hemolitik pada janin dan bayi baru lahir, pertama kali dijelaskan pada 1609 dalam rangkaian bayi kembar: bayi pertama adalah hidropik dan lahir mati, dan bayi kedua sangat kuning dan kemudian meninggal yang sekarang kita sebut kernicterus. Pada1932, ditemukan bahwa hydrops dan kernicterus adalah dua aspek dari penyakit yang sama di mana hemolisis sel darah merah janin dan neonatus mengakibatkan extramedullary erythropoiesis, hepatosplenomegali dan pencurahan erythroblasts ke dalam sirkulasi, suatu kondisi yang disebut erythroblastosis fetalis. Kernicterus selanjutnya terbukti karena pengendapan bilirubin dalam otak. (Bowman, 1998). Hemolytic disease pada fetus muncul pada bayi dengan RhD yang positif yang dibawa oleh ibu dengan RhD negatif yang telah diimunisasi sel darah merah dengan RhD positif melalui transplacental barrier selama periode kehamilan. Antibodi IgG maternal hingga RhD melewati placenta, melapisi dan menghancurkan sel darah merah RhD positif janin.(Lo YMD, et al., 1998). Kasus inkompabilitas RhD tidak hanya membahayakan bayi tetapi juga orang dewasa, khususnya saat melakukan transfusi darah. Orang dengan RhD negatif lebih berisiko karena ketika mereka menerima darah dari orang dengan rhesus positif, antibodinya akan menyerang sel darah merah yang baru masuk tadi. Hal ini dapat menyebabkan aglutinasi dan bahkan kematian. (Anitei, 2008)
Pembahasan selanjutnya mengenai sel darah putih yang merupakan salah satu komponen sistem pertahanan tubuh kita. Leukosit terdiri atas sel fagosit dan sel imunosit. Yang termasuk sel fagosit adalah neutrofil (PMN), eosinofil, basofil, dan monosit. Sedangkan limfosit dan sel plasma termasuk sel imunosit. Pada keadaan normal, perbandingan persentase komponen leukosit adalah : netrofil 62%, eosinofil 2,3%, basofil 0,4%, monosit 5,3%, limfosit 30%. Persentase netrofil akan mengalami peningkatan saat terjadi infeksi bakteri, eosinofil meningkat pada reaksi alergi dan infeksi parasit, sedangkan basofil akan meningkat jumlahnya pada kondisi inflamasi jaringan.( Bregman, 1996).
Penghitungan diferensial leukosit ternyata memberi makna klinis yang signifikan terhadap beberapa kelainan di dalam tubuh. Leukosit memiliki peranan sebagai pertahanan tubuh terhadap berbagai agen toksik dan infeksi. Mekanismenya antara lain dengan menghancurkan agen invasif melalui proses fagositosis dan membentuk antibodi dan limfosit yang disensitifkan. Kenaikan titer salah satu atau beberapa jenis leukosit ternyata memberikan indikasi penyakit tertentu, misalnya apendisitis, terjadi kenaikan leukosit dan netrofil yang cukup signifikan dan berperan dalam proses inflamasi. Bahkan derajat inflamasi apendisitis dapat diketahui dengan jumlah leukosit dan netrofil PMN pasien. (Horng-Ren Yang, et al, 2006). Berbagai keadaan-keadaan yang menyebabkan peningkatan dan penurunan jumlah sel leukosit.
- Neutrofil leukositosis
Dikatakan leukositosis apabila jumlah neutrofil berada pada level > 7,5 x 109. Karakteristik leukositosis: terjadinya pergeseran ke kiri dari dalam differential white cell count pada apusan darah tepi. ada beberapa penyebab neutrofil leukositosis, yaitu : Infeksi bakteri (bakteri pyogenic), Inflamasi dan nekrosis jaringan, kelainan metabolisme, misal, uremia, asidosis, gout, Neoplasma, hemolisis atau hemorargi akut, terapi kortikosteroid.
- Neutropenia
Jumlah neutrofil terendah adalah sekitar 2,5 X 109/l. Ketika level neutrofil absolute mencapai 0,5 X 109/l menandakan pasien mempunyai infeksi yang sifatnya kambuhan (recurrent) dan pada saat jumlahnya hanya 0,2 X 109/l, menandakan bahwa ada kelainan fungsi tubuh.
(Hoffbrand & Pettit, 1998)
Pada percobaan Identifikasi dan Kuantitatif Sel Leukosit dilakukan penghitungan jenis leukosit per 100 sel leukosit, dan hasilnya diubah dalam persen. Penghitungan pada sampel darah probandus 1 dengan menggunakan perbesaran 1000X didapatkan hasil sebagai berikut : basofil 0%, eosinofil 0%, netrofil 0%, limfosit 75%, monosit 18%. Selanjutnya Probandus II menggunakan perbesaran 400x didapat hasil: basofil 2,4%, eosinofil 14,8%, netrofil 54,3%, limfosit 8,6%, monosit 7,4 %, sedangkan pada probandus III didapat hasil: basofil 10,1%, eosinofil 10,1%, netrofil 43,4%, limfosit 30,4%, monosit 5,7 %. Jumlah eosinofil, basofil dan monosit relatif sedikit pada persentase. Mengingat fungsi utama netrofil adalah fagositosis, sehingga kenaikan netrofil menjadi dalah satu indikator proses inflamasi (peradangan) dan infeksi. Leukosit ini juga memberi respon fagositik dan berperan pada proses peradangan. Secara klinis, eosinofilia terjadi terutama jika terjadi reaksi alergi dan infeksi cacing, sedangkan basofil berperan dengan sel mast dalam melepaskan heparin ke dalam darah sehingga mencegah koagulasi darah.
Hasil yang didapatkan berbeda dengan standar teori yang ada. Kesalahan ini selain disebabkan karena kesalahan pada saat mengidentifikasi, juga dapat dikarenakan terjadinya penghitungan ulang pada wilayah yang sama pada saat mengamati dengan mikroskop. Penggunaan perbesaran mikroskop yang berbeda dalam perhitungan juga bisa menjadi salah satu pemicu perbedaan hasil. Kesalahan lain bisa disebabkan pada saat pembuatan preparat apus, dimana sampel darah yang digunakan terlalu tebal ataupun terlalu tipis sehingga tidak terlihat pada saat pengamatan dengan mikroskop. Kemungkinan terakhir yakni tubuh probandus benar-benar sedang dalam keadaan patologis
KESIMPULAN
Aglutinasi yang terjadi pada pemeriksaan golongan darah menunjukkan adanya interaksi antara antigen-antibodi yang sejenis. Penghitungan diferensial jumlah relatif leukosit berfungsi untuk mengetahui kondisi-kondisi patologis yang secara klinis dapat diketahui dengan pemeriksaan laboratorium.
DAFTAR PUSTAKA
Anitei, Steffan. 2008. The Rh Factor . Softpedia
http://news.softpedia.com/newsPDF/The-Rh-factor-84767.pdf (diakses:24 september 2009)
Bellanti, J.A. & Jackson, A.L. 1993. Imunologi III. Jogjakarta: Gadjahmada University press.
Bowman, J.M., RhD Hemolytic Disease of the Newborn. NEJM.1998 ; (339) : 1775-1777
Bregman, Ronald A., 1996, Histology, W. B. Saunders Company : Philadelphia
Eaves-Pyles, T., Alexander, J. W. The Effect of Blood Transfusion on Susceptibility to Bacterial Infection in Genetically Defined Mouse Models. Lippincott Williams & Wilkins. 1997: (43): 894-898
Fried, G.H & Fried, G.J., 2006. Schaum’s Outlines Biologi, edisi kedua. Jakarta: Penerbit Erlangga.
Ganong, William. F., 2001, Review of Medical Physiology, 20th ed., The Mc. Graw – Hill Companies Inc. : Sanfransisco
Guyton, Arthur C & Hall, John E.2007.Fisiologi Kedokteran, edisi 11. Jakarta: EGC.
Hoffbrand, A.V & Pettit, J.E. 1998. Essential Haematology 3rded. Blackwell Science, Oxford, London
Horng-Ren Yang, Yu Chun Wang, Ping Kuei Shung et al. Laboratory Tests in Patients with Acute Appendicitis. ANZ Journal of Surgery. 2006; 76 (1-2): 71 – 74
Lee, G. Richard.,Foerster, John.,Lukens John., Paraskevas, frixos., Greer, John P., Rodgers, George M. 1999. Wintrobe’s Clinical Hematology 10thed. Williams &Wilkins Company
Lo YMD, Hjelm NM, Fidler C, et al. Prenatal diagnosis of fetal RhD status by molecular analysis of maternal plasma. N Engl J Med 1998;(339):1734-1738.
Mayer, Gene. 2009. Immunoglobulins- Antigen-Antibody Reactions and Selected Tests . University of South Carolina. http://pathmicro.med.sc.edu/mayer/ab-ag-rx.htm
Sheehan, Catherine.1997. Clinical Immunology Principles And Laboratory Diagnosis 2nded. Lipincott: Philadelphia, New York
Yuwono, T. 2008. Biologi Molekular. Jakarta:Erlangga.

